服务电话 Service Hotline:(0086)-731-88995848
> 新闻中心 > 公司动态2025版《中国药典》的这些变化,你get了吗?
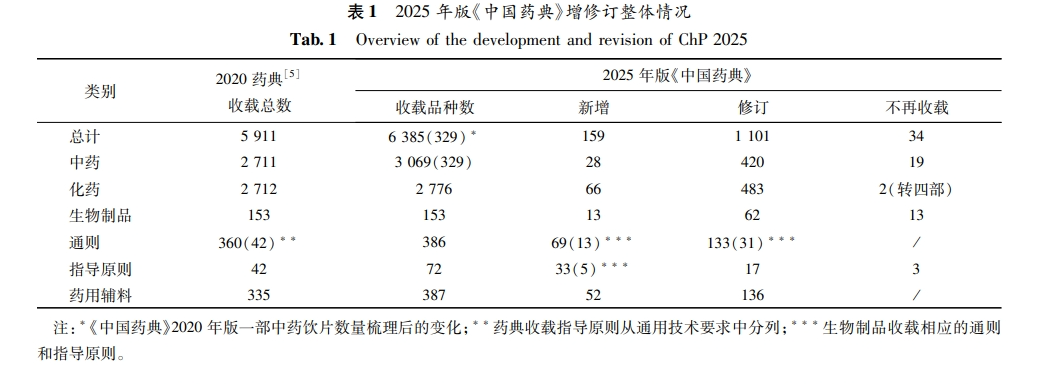
2025年版《中国药典》收载品种总计6385种,新增159 种,修订1101种,不再收载32 种。其中一部中药收载品种共计3069种,新增28种,修订420种,不再收载 19 种;二部化学药收载品种共计2776 种,新增66种,修订483种,不再收载而转四部收载2个药用辅料品种;三部生物制品收载品种共计153 种,新增13种,修订62 种,不再收载13 种;四部收载药用辅料共计387种,新增52 种、修订136种。
本版药典收载通用技术要求共计410个,新增69个,修订133 个;其中三部生物制品新增通则(总论)13 个,修订31个;四部新增通则56个、修订102个。
本版药典收载指导原则共计72个,新增33个,修订 17个不再收载3个。其中三部生物制品新增5个,四部新增28个,修订17个,不再收载3个(见表1)。
2025年版《中国药典》
主要变化
图片来源:中国国家药典委
2025版《中国药典》收载
化学成像技术
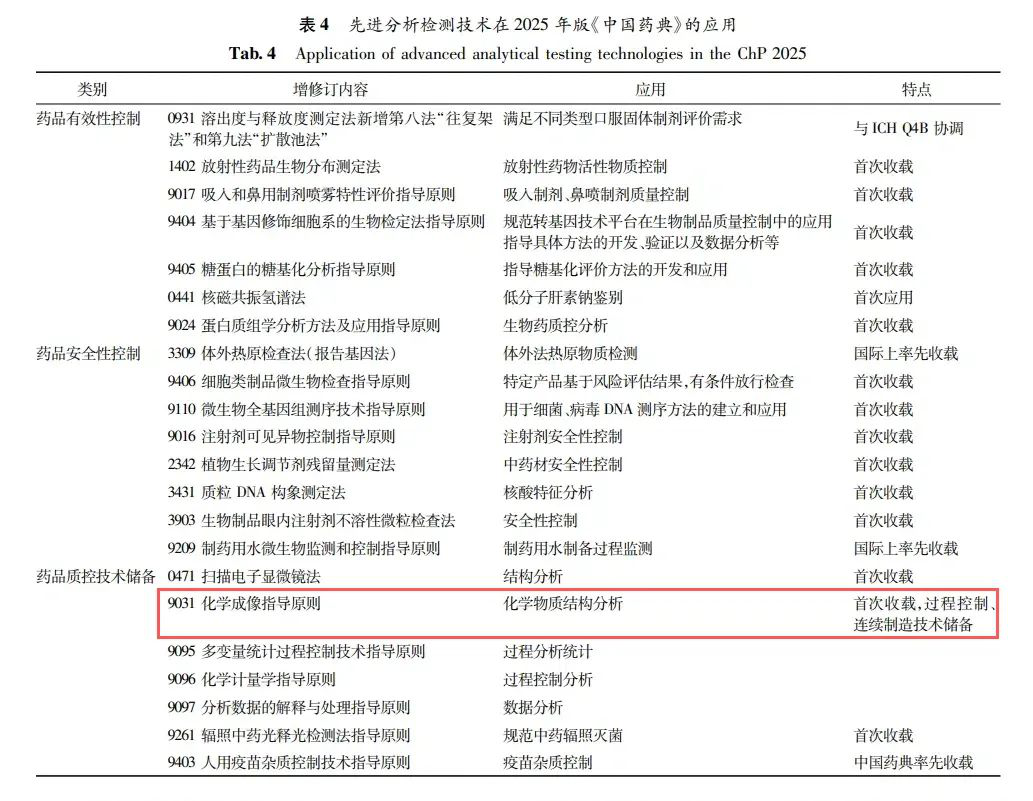
2025年版《中国药典》紧跟国际制药发展前沿,关注热点领域,加快推进医药创新形成的新技术、新方法、新工具标准转化,不断扩大成熟先进检测技术的应用,为药品质量控制提供规范性好、适用性强、应用稳定、可靠性高的检测方法,药品质量可控性得到显著提升。
其中,新增的《9031化学成像法指导原则》与欧洲药典标准保持一致,是本次药典修订的一大亮点。
化学成像技术可同时提供样品的成分信息与空间信息,能可视化分析样品表面的分布特征,可实现不同样品之间的快速和无损比较,是传统光谱分析方法的重要补充。该指导原则的增订旨在为化学成像在药品成分鉴别、含量分布评估、物理形态表征等应用中提供指导,促进多信息融合检测技术在我国制药行业的应用。主要内容包括适用范围、成像特点、成像系统、采集模式和成像过程。
2025年版药典的颁布实施,标志着我国药品质量控制水平迈上了一个新台阶。化学成像技术的引入将为药品质量控制提供更强大的技术支持。福州华为医药依托27年深耕制剂开发领域的专业积淀,构建了以化学成像、近红外、拉曼光谱等光谱技术为主导的特色分析技术体系。详见如下:
1. 晶型分析
利用化学成像(Chemical imaging)、拉曼光谱(Raman)、近红外光谱(NIR)、粉末衍射(XRD)等技术,实现原料药和制剂晶型定性和定量。研究晶型稳定性、一致性、杂晶的控制。尤其是化学成像技术,可以实现制剂包括小规格制剂中原料药的晶型分析。利用化学成像和近红外光谱结合化学计量学建立定量模型,提供晶型的定量服务,满足发补定量分析要求。
2. 粒度分析
利用化学成像、显微图像分析、扫描电镜、激光粒度仪等技术方法,提供原辅料的粒度分析、参比制剂原辅料粒度分布解析。2024年6月CDE发布的《化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则》中已推荐拉曼成像法(属于化学成像法)应用于药物粒度分布分析。
3. 工艺分析
利用化学成像法,进行制剂各组分分布分析和生产工艺推断,如制粒工艺(物料内加/外加,湿法/干法制粒),投料顺序分析,孔隙率分析等。
4. 处方解析
利用光谱法、化学成像法,提供制剂中原辅料逆向解析。包括原辅料鉴别、晶型、粒度、型号定性分析以及定量分析。
5. 物质鉴别
利用光谱法、化学成像法、液质、气质联用等方法,可提供物质鉴别,包括晶型、盐基、水合物、未知物结构解析等服务,包括液体制剂中析出物(可见异物)的鉴别。
6. 其他
制剂生产、稳定性试验过程出现的质量问题包括但不限于粘冲、裂片、溶出下降等的分析,混合均匀性评价。
免责声明:文章来源或改编自互联网及其他公众平台,版权归原作者所有,内容仅供学习参考。